研究紹介総説「放射性医薬品の体内動態制御とターゲティングコンファーマティブ個別化医療」
近年、分子標的薬剤など有効性の高い医薬品が使用され始めているが、薬効や副作用に個体差が大きく、また、現状の個別化医療はもっぱら標的分子や遺伝子変異の有無のような質的診断に基づいており、有効性の限界、副作用の問題が必ずしも回避できていない。真の個別化医療の実現には、医薬分子の体内動態、すなわち標的組織のみならず副作用部位への薬剤集積量を定量的に個別に評価する必要がある。核医学イメージングは、まさに薬物動態を定量的に把握し得る手法であり、個別化医療への展開が可能である。本稿では、分子イメージング的戦略に基づく放射性医薬品開発の現状と放射性医薬品に対する新しい体内動態制御の試みを紹介する。さらに、内用放射線治療薬剤を例に挙げながら、癌の診断・治療を目的とした放射性医薬品のドラッグデザインの一端を紹介するとともに、核医学イメージングの個別化医療への応用について概説する。
核医学画像診断・放射性医薬品
核医学画像診断は、組織の形態診断を得意とするX線診断やMRI (magnetic resonance image)とは異なり、体内組織の生理的機能・代謝機能・神経伝達機能・機能性分子発現などの機能診断を目的とする。この核医学画像診断に用いられる医薬品を放射性医薬品という。放射性医薬品には、診断用と治療用があり、さらに診断薬は標識核種によって陽電子断層撮影(positron emission tomography, PET)に用いられるPET製剤と単光子断層撮影(singlephoton emission computed tomography, SPECT)用のSPECT製剤に大別される。最近ではこれらの診断画像の位置情報の信頼度を高めるためにX線断層撮影(CT)との融合装置が利用され始め、さらには基礎研究用にこれらの小動物用高分解能装置も開発されている。
分子イメージングと新規放射性医薬品の開発
核医学画像法を含めた生体内の分子レベルの挙動を可視化する「分子イメージング」は、今後、医療に大きく貢献することが期待されることから、米国では2001年に国立バイオメディカルイメージング・バイオエンジニアリング研究所(NIBIB)が創設され、翌年からの2年間に約4億ドルの予算が投入された。本邦でも2006年5月には日本分子イメージング学会が設立され、生体分子のイメージングをキーワードとする多数の研究者が参画し、「multimodality」時代の到来を感じさせた。
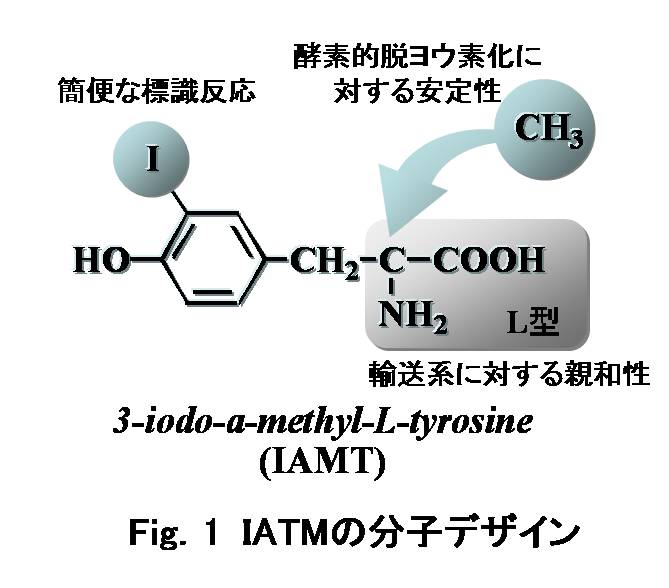 |
一方、精神疾患や認知症などの脳内神経変性疾患の早期検出が望まれている。そのためには、神経変性過程において、神経細胞のどの機能変化が先行指標となり得るか、すなわち変性過程の早期に変化し、発症に至る神経細胞の機能変化は何かを明らかにする必要がある。ドーパミン作働性神経系をはじめとする脳内神経伝達機能の新規核医学診断薬の開発は、最も要望されているところであり、その中でもトランスポータにより特異的に脳細胞内に取り込まれ、神経伝達物質の生合成原料となるアミノ酸誘導体は重要な候補化合物であると考えられる。半減期が短い11C、13N、18Fなどのポジトロン放出核種に対し、企業供給の可能な 123I標識SPECT製剤の利用が臨床応用性の観点から注目されているが、一般に原子半径の大きい放射性ヨウ素で標識された低分子化合物が代謝親和性を保持することは難しい。筆者らは、これまでに、脳内神経伝達物質の生合成前駆体であるL-チロシンを母体化合物として利用し、トランスポータが光学異性体選択的であることからL-体構造を保持したまま、脱ヨウ素化反応をはじめとする分解代謝に対する抵抗性を向上させるためのα-メチル基を導入した3-ヨード-α-メチル-L-チロシン (IAMT, Fig.1) が、脳の中性アミノ酸トランスポータ機能を選択的に測定し得ることを報告してきた [Kawai K.;19911), 19922), 19953)]。また、脳内神経終末でL-チロシンを神経伝達物質に変換する芳香族アミノ酸脱炭酸酵素(AADC)活性測定を目的として、AADC阻害剤のプロドラッグ化薬剤3-ヨード-α-ジフルオロメチル-L-チロシンメチルエステル (IFTM, Fig.2) を考案した[Kawai K.; 19994)]。IFTMは予想通りエステル化による高い脂溶性により脳内に移行した後、エステラーゼなどの酵素によるエステルの解裂の結果、偽基質が生成することが確認された。実際、サル頭部SPECT検討において、AADC阻害剤NSD-1015前処理によりドーパミン作働性神経密度が高い線条体領域の集積が有意に低下したことから、IFTMは脳内神経終末のAADC活性を反映すると考えられた (Fig.2) [Kawai K.; 19975)]。
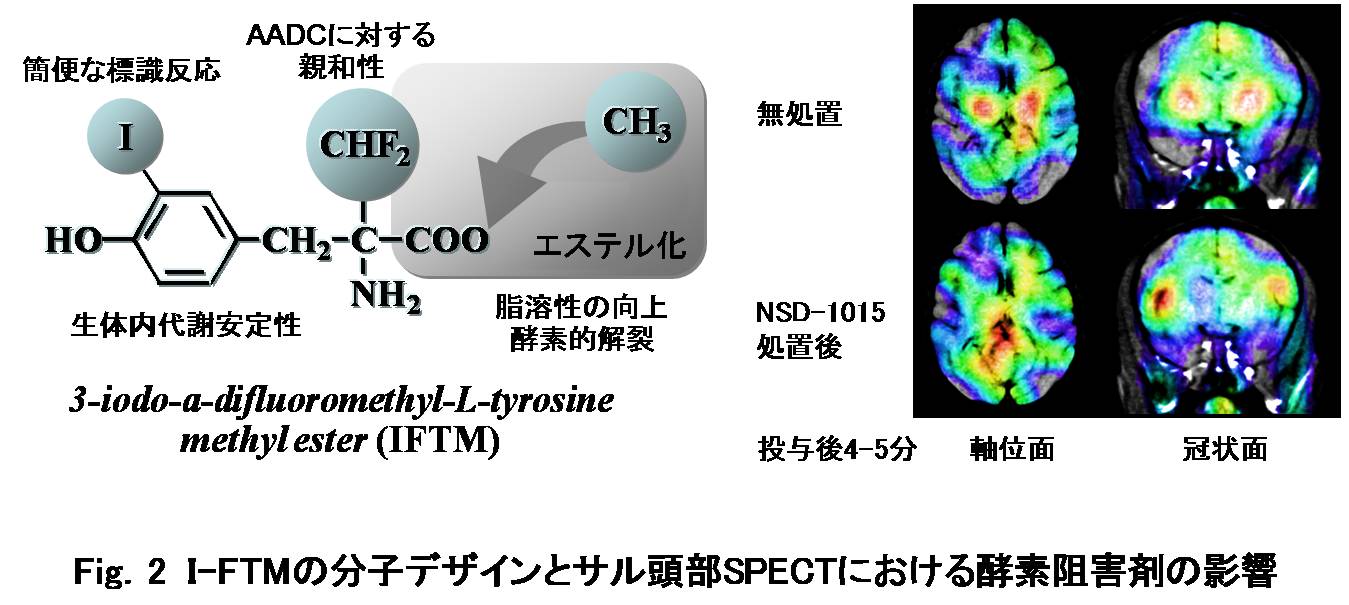 |
これらの神経終末機能診断を含め、ドーパミン作働性神経機能診断薬の候補化合物をFig.3に示す。このように核医学画像診断に用いる放射性医薬品は、機能性分子を標的としてそれらとの相互作用による分布動態の可視化・機能解析を目指し、ドーパミン作働性神経だけをみてもFig.3のように機能性分子を対象とした画像診断薬が網羅的に開発されてきており、核医学画像法はまさに「分子イメージング」を代表する手法となっている。
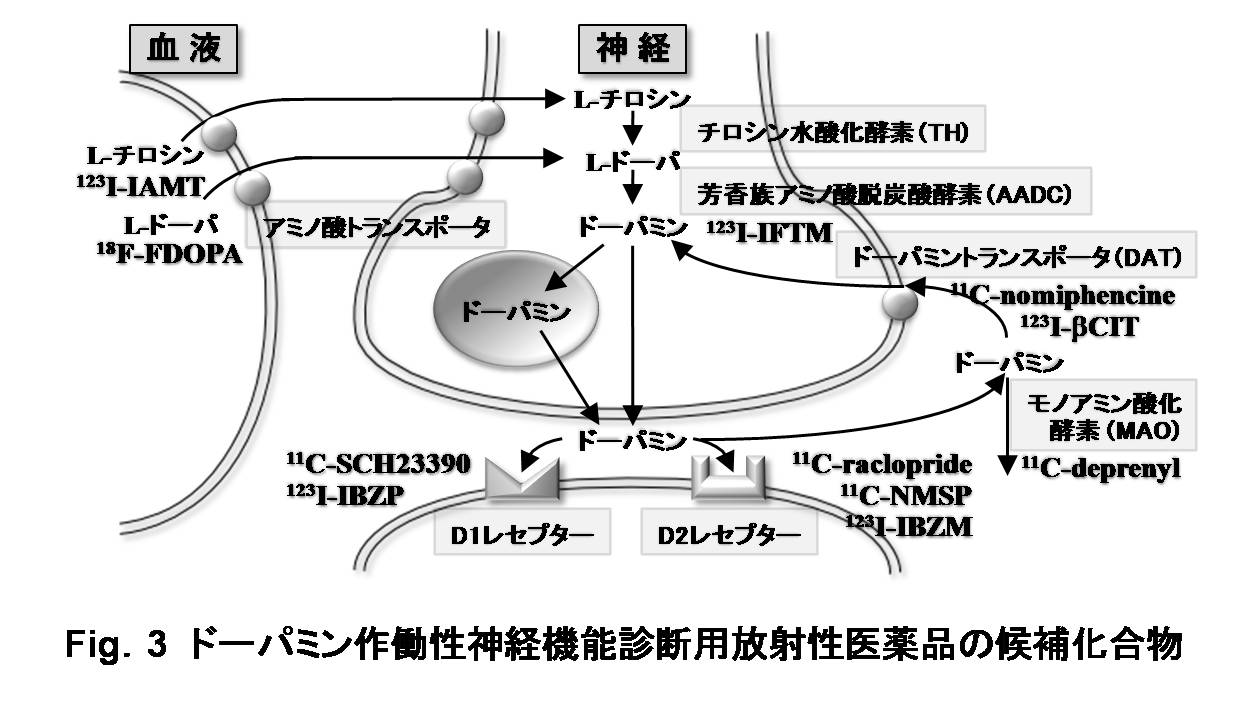 |
分子イメージングによる早期診断・治療効果判定
さらにこれらの分子イメージング技術を応用し、神経機能との関わりが深い放射性診断薬を用いて、種々の脳内神経変性疾患モデル動物の発症過程における同一個体での機能変化と病態発症との関係を評価することが可能である。
例えば、パーキンソン病モデルラットは、神経毒である6-ヒドロキシドーパミン脳内投与2週間後にメタンフェタミン誘起回転運動を測定し、片側神経破壊が確認されたラットを用いるが、薬物投与した全例が発症するとは限らない。さらに、処置後発症に至る機能変化は動物を屠殺して測定するため、その個体のその後の発症を確認することができない。一方、核医学診断法は、生きた状態を維持したまま、同一個体で経時的/経日的にこれらの機能変化を追跡できるため、機能変化後の発症を確認できる利点を有する。そこで、パーキンソン病発症期における神経機能変化の解明を目的とし、メタンフェタミン誘起による行動薬理試験で完全破壊が確認された発症期ラットのみならず、処置後3日目の急性期群も加え、発症過程にみられる脳内ドーパミン神経路における経日的な機能変化をFig.3のPET製剤投与により画像化し、解析した。その結果、小脳では、急性期・発症期のいずれにおいても無処置側に対する破壊側の集積比に顕著な変化はみられなかった。大脳皮質への集積では、ドーパミン代謝機能を反映する 18F-6-フルオロ-L-ドーパの集積比のみが発症期に有意に低下した。一方、ドーパミン作働性神経が密集している線条体においては、ドーパミンD1レセプターリガンド 11C-SCH23390では顕著な変化を示さなかったが、D2レセプターリガンドである 11C-ラクロプライドの集積比は、急性期から明らかな増加がみられ、発症期にはupregulationによってさらに増加した。ドーパミン動態では急性期に低下し、発症期には回復する傾向がみられた [Ishida Y.; 20046)]。特に、急性期におけるこれらの変化は、行動薬理試験による破壊判定に先駆けて確認されたことに加え、免疫染色の結果とも相関しており、発症過程の先行指標になり得ると考えられた [Ishida Y.; 20057)]。このように、PET製剤による画像化において、処置後早期より神経機能変化を検出し得たことから、これらを用いたパーキンソン病早期画像診断への応用が期待される。また、同じパーキンソン病モデルラットに胎児脳細胞を移植したラットを再生医療モデルとして検討を進めている。最近では、レポータ遺伝子を導入し、その発現分子をイメージングすることで移植後の機能分化を評価する治療効果判定への応用も試みられている。
FDG-PET検査の有用性
核医学画像診断の中でも、PETは核種の崩壊に伴い放出される陽電子(positron)が、近傍の電子と結合し消滅する際に同時に正反対方向に放出される2本の消滅X線を同時計数することによって断層画像を構成するため、感度、空間分解能、定量性のすべてに優れる特色を有する。一方、PET検査に用いるポジトロン放出核種が超短半減期(2~110分)であるため、従来、PET用放射性医薬品は、院内に設置されている医療用サイクロトロンによって診療現場で調製する必要があり、使用できる施設が限られていた。しかしながら、2002年に2-デオキシ-2-18F-フルオロ-D-グルコース (18F-FDG) が保険適用されたことに伴い、PET検査数は急激に増加し、さらに、2005年に18F-FDGの企業供給が開始されるに至って、PETカメラの導入のみでPET診断が行えるようになり、PET検査施設が急増した。
18F-FDGによるPET検査は、悪性腫瘍をはじめ、虚血性心疾患やてんかんなどの疾患の診断に有用であり、FDG-PETはPET診療の代名詞になっている。18F-FDGはD-グルコースの構造類似体として、グルコーストランスポータ (GluT) によって細胞内に取り込まれ、ヘキソキナーゼによりリン酸化を受けて細胞内に留まるいわゆる「metabolic trapping」によって組織に集積する標識化合物である。そのため、エネルギー産生の盛んな脳の活動部位を描出するbrain mappingへの応用も試みられている。FDG-PET検査は、癌の位置や大きさの同定、転移巣の検出などの存在診断のみならず、1. 病期診断、2. 治療効果予測、3. 治療効果判定、4. 予後推定の各段階で有効であり、形態画像診断とは異なる情報を提供することで、治療の個別化への寄与が報告されている。最近では、形態画像との正確な融合が可能なPET/CTの導入もめざましく、民間病院を中心に癌の早期発見を目的とした検診へも応用され、FDG-PET検診ツアーもインターネットを賑わしている。
Post-FDG PET製剤の開発動向とアミノ酸代謝イメージング剤
しかしながら、FDG-PETも万能ではなく、腫瘍診断薬としてのいくつかの問題点も指摘されている。前述のように、18F-FDGはD-グルコース誘導体として、エネルギー産生の盛んな腫瘍に高集積を示すものの、同様にエネルギー代謝活性の高い脳や心臓などの正常組織にも生理的に集積する。また、腎尿細管管腔側の再吸収トランスポータ (SGLT) に対する親和性が失われているために尿排泄性が高く [Kobayashi M.; 20108)]、投与後早期から膀胱に移行するため、これらの正常集積を示す組織やその周辺に存在する腫瘍の検出は難しい。 さらに、炎症組織にも集積することから、腫瘍との鑑別は困難である。しかしながら、医療用院内サイクロトロンを有する一部の診療施設を除けば、診療に使用できる放射性医薬品は、現状では唯一 18F-FDGのみである。したがって、PET検査のさらなる充実には、上記の 18F-FDGの問題点を補うPET製剤、あるいは 18F-FDGとは異なった集積機序を有し、新たな診断情報をもたらす「post-FDG」製剤の開発が強く望まれている。これらのpost-FDG PET製剤の開発動向に関しては、日本放射線技術学会雑誌62巻に掲載された総説 [川井恵一; 20069)]を参照されたい。
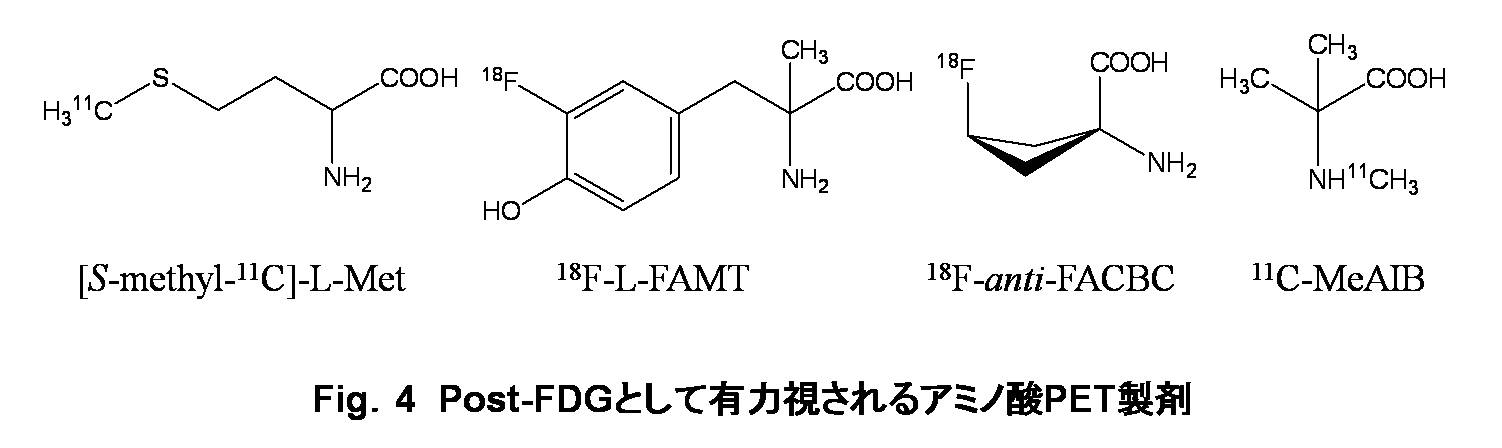
Post-FDG PET製剤の中でもアミノ酸代謝イメージング剤は、最も有望視されている。画像診断を目的とした75Se、131Iなどのシングルフォトン放出核種標識アミノ酸の開発は1960年代にまで遡る[Blau M.; 196110), Blomquist L.; 196811), Counsell RE.; 196812)]が、1970年代後半からは、医療用サイクロトロンの病院内設置によって、11C、13N、15Oなどの有機化合物の構成元素である超短半減期ポジトロン放出核種が利用可能となり、PET診断用標識アミノ酸の合成、評価が開始された。11Cあるいは13Nの利用によって、天然アミノ酸の化学構造を変化させずに標識できるため、代表的なアミノ酸代謝である蛋白質合成を画像化し得ることが最大の利点である。しかしながら、これらの核種の半減期は一番長い11Cでも 20分と短く、標識合成に時間的な制約が大きかった。また、天然のアミノ酸はグリシンを除いて光学活性であり、生体はL-体のみを利用しているが、アミノ酸の不斉合成は非常に難しい。[S-メチル-11C]-L-メチオニン ([S-methyl-11C]-L-Met, Fig.4)は、自動合成装置から得られる 11C-ヨウ化メチルを利用して、1段階反応で容易に合成でき、加えて標識原料にL-ホモシステインを用いることでL-体のみを得ることができることから、上述の制約を克服するアミノ酸製剤として、古くから臨床応用されてきた。しかしながら、生体内に投与された化学物質は、速度の差はあれ、代謝によって化学構造が変化する。
特に、天然アミノ酸のように元来栄養素として利用される化合物は、多様な酵素の基質となって、数分レベルで代謝変化を受けるので、その結果の解析には、これら代謝の影響を考慮しなければならない。栄養素であるL-メチオニンなどの天然アミノ酸は細胞内に取り込まれた後、蛋白質生合成の原料として蛋白質に組み込まれる。また、アミノ酸が分解されると最終的に脱炭酸を受け、カルボニル基(1位炭素)は二酸化炭素CO2として細胞外に排出される。さらに、L-メチオニンに特有の代謝経路としてS-アデノシル-L-メチオニンを経てS-メチル基がメチル基転移を受ける。これらの代謝を模式的に示すとFig.5のようになる。このように、本来アミノ酸代謝の中でも蛋白合成機能を反映することが天然アミノ酸の利点であったが、[S-methyl-11C]-L-Metの標識部位であるS-メチル基は細胞内でメチル基転移を起こすことから、他の炭素を標識した場合と比較して、放射性炭素が蛋白質に組み込まれる割合、すなわち蛋白合成を反映する割合が低くなる (Fig.5) [Fujibayashi Y.; 199013)]。この問題を解決するためには、カルボン酸か側鎖中心部の炭素を標識すればよいが、前者は不斉合成が困難であり、後者は合成に時間を要することから実用的でない。このような理由で、[S-methyl-11C]-L-Metは現在でも臨床に利用され、その集積は蛋白合成を反映しているとされているが、前述のメチル基転移により11Cは低分子代謝物に移行するため、集積放射能の蛋白組み込み率は50%程度でしかないことを考慮する必要がある。
 |
一方、消化管のアミノ酸吸収を担うアミノ酸トランスポータを研究する目的で、1960年代初頭には、天然アミノ酸とは異なり代謝による構造変化を受けない種々の人工アミノ酸が開発されており [Akedo H.; 196214)]、70年代にはこれら人工アミノ酸の11C標識体の応用も検討された。中でも、アラニンのα-炭素にメチル基を導入したα-アミノイソブチル酸 (AIB) [Dunzendorfer U.; 198115)] および側鎖に飽和環状構造を有するα-アミノ酸であるα-アミノシクロブタン-1-カルボン酸 (ACBC) [Hayes RL.; 197616)]、α-アミノシクロペンタン-1-カルボン酸 (ACPC) [Washburn LC.; 197917)] などは、アミノ酸トランスポータに高い親和性を有し、その側鎖構造の対称性によって光学活性を示さないことから、カルボン酸を11C標識した [1-11C]標識体の有用性が検討された。
腫瘍はその増殖に必要な蛋白合成が盛んであり、天然のアミノ酸の利用率も高いことが古くから知られていたが、蛋白合成には利用されない人工アミノ酸も同様に腫瘍に高集積を示す。これは、蛋白合成の原料であるアミノ酸を輸送するアミノ酸トランスポータが、腫瘍では高発現している結果であり、このアミノ酸トランスポータ機能を診断指標とするならば、代謝の影響を受けない人工アミノ酸の応用が有望である。そこで、18F-FDGと同様に半減期の長い18F標識人工アミノ酸に開発の視点がうつってきている。
これまでにハロゲンを安定に導入できるチロシンなどの芳香族アミノ酸を利用し、数多くの18Fあるいは123Iなどの放射性ハロゲン標識アミノ酸が合成され、評価されてきた。当初は、蛋白合成への関与も期待したが、蛋白質への組み込みはごく僅かであり、その集積はアミノ酸トランスポータによるものであった。生体内代謝安定性を考慮して開発された前出の 123I-IAMTは、アミノ酸トランスポータ機能診断薬として優れた性質を有していることから、PET製剤化を目指して放射性ヨウ素を18Fに置き換えた 3-18F-フルオロ-α-メチル-L-チロシン (18F-L-FAMT, Fig.4)が開発された[Inoue T.; 199818)]。18F-L-FAMTは、脳、心筋、肝、筋肉など、腎以外の主要組織への生理的集積が 18F-FDGより低く、脳腫瘍がより明瞭に描出されること、悪性腫瘍に対する診断能が 18F-FDGより高いことなど 18F-FDGの欠点を補うだけでなく 18F-FDGより優れる点もあることが報告されている。また、前述したアミノ酸トランスポータに高い親和性を示す人工アミノ酸の中で、11C標識体を用いた実験において最も高い腫瘍選択性を示したACBCを18Fで標識した 18F-FACBC (Fig.4) がGoodmanのグループによって開発された [Shoup TM.; 199919)]。18F-FACBCには立体異性体が存在し、cis-体に比べanti-体の方が腫瘍選択性が高い。FDG-PET像では腫瘍の存在が明確に識別できない神経膠芽腫の症例で、18F-anti-FACBCは腫瘍部位を明瞭に描出するなど、これらの標識人工アミノ酸は、腫瘍診断においてFDG-PETとは異なった特性を示す「post-FDG」製剤として期待されている。
一方、近年の分子生物学の進歩に伴い、分子クローニングによってアミノ酸分子構造の多様性を反映する40種類を超えるアミノ酸トランスポータの存在が解明され、特定のアミノ酸の輸送に複数のトランスポータが介在していることが明らかになった [金井好克; 200320)]。さらに最近では、画像診断薬のトランスポータアイソフォーム選択性も報告されるようになってきている [Shikano N.; 2003a21)]。アミノ酸トランスポータの中でも高い輸送活性を示す中性アミノ酸トランスポータは、比較的短い側鎖のアミノ酸を輸送するNa+依存性のsystem A, system ASCと、嵩高い側鎖のアミノ酸を輸送するNa+非依存性のsystem Lに大別され、[S-methyl-11C]-L-Metは主にsystem Lにより細胞に取り込まれている [Langen KJ.; 200022)]。また、system Lに特異的なSPECT用診断薬も報告された [Shikano N.; 201023)]。一方、18F-anti-FACBCもこれまでsystem Lにより細胞に取り込まれると考えられてきた19)が、前立腺腫瘍では主にsystem ASCが細胞集積に関与していることが明らかとなった [Okudaira H.; 201124)]。さらに、前述の α -アミノイソブチル酸(AIB)のN-メチル体(MeAIB)はsystem Aの特異的基質として利用されているが、その11C標識体 11C-MeAIB (Fig.4) も新たなアミノ酸トランスポータプローブとして本邦でも合成が開始され [Nishii R.; 200925)]、これを用いた臨床研究が米国核医学会のベストポスター賞を受賞した [Higashi T.; 201026)]。今後、アミノ酸の組織集積に重要な役割を果たすアミノ酸トランスポータ発現の正常組織‐腫瘍細胞間での質的・量的相違を解析し、薬剤開発における分子設計戦略に利用することは、アミノ酸を標識母体構造とするアミノ酸代謝イメージング剤の腫瘍選択性の向上に重要な情報を与えることであろう。
 |
薬物動態モニタリングへの応用
さらに、このような核医学画像診断法は、生体内の機能情報を
■ 生きた状態で
■ 非侵襲的に
■ 同一の個体で
■ 経時的に
■ 繰り返し
測定することができる「in vivo トレーサー法」としての特徴を有している。このようにこれまでも脳神経から各種組織の代謝機能や腫瘍などの病巣組織の特異的発現分子などを標的として、生体内機能分子との相互作用によって生体機能を可視化し解析が可能な放射性プローブを開発し、疾患の早期診断のみならず治療の早期判定などの先進的基礎研究を推進してきた。さらに、後述する個別化に関連する薬物療法の有効性予測に関する研究的アプローチも開始し、特定の分子標的薬剤や遺伝子治療・再生医療の効果予測に有用な放射性プローブの提唱も行ってきた。
これらの放射性プローブを用いた体内動態定量法は、そのままヒトへの応用が可能な薬物動態モニタリング法として有用性が高い。例えば、経口製剤の血中濃度推移の予測において、吸収と同様に消化管内移行が重要な因子となるが、個体差や摂食状態に大きく依存する。この消化管移行をイメージングによって個別に経時的に可視化し、モニタリングすることで移行パラメータを実測でき、薬物の血中濃度推移を良好に予測し得ることも報告してきた [Haruta S.; 200127), 200228)]。したがって、画像診断法を「薬物動態可視化定量法」として活用することによって、「有効で安全な個別適正投与量の決定」などの真の個別化医療の実践に必要な情報を患者個別に取得することが可能になる。
腎尿細管分泌阻害による放射性医薬品の体内動態制御
一方、核医学機能診断に応用する放射性標識化合物は、投与後早期から画像化に必要なコントラストを得るために、標的組織に高く集積するとともに、速やかに尿中へと排泄されるものが望ましい。そこで、上述したアミノ酸トランスポータ機能診断薬IAMTの尿排泄機序を検討した結果、その腎尿細管輸送においてアミノ酸輸送系や有機酸輸送系などの特定の輸送蛋白が関与していることが確認された [Shikano N.; 2004a29)]。また、アミノ酸輸送蛋白の特定アイソフォーム発現系における輸送特性を検討し、IAMTがヒトL-型アミノ酸トランスポータ-1 (hLAT-1) に特異的に高親和性を有することを見い出した [Shikano N.; 2003a21), 2003b30)]。さらに、IAMTの腎上皮細胞の単層培養細胞系における集積機序を詳細に検討し、14C標識L-チロシンの結果と比較することにより、これらの輸送機構を明らかにした [Shikano N.; 2004b31)]。このように高い腎排泄性を示す放射性ヨウ素標識アミノ酸の腎尿細管輸送特性は、速やかな体外排泄性を示す代謝機能診断用ヨウ素標識薬剤の設計戦略に極めて重要な知見を与え得るものである。
また、一般に、放射性医薬品の目的臓器への集積率は血中濃度に依存するが、この血中濃度は腎排泄によって経時的に低下していく。尿排泄性の高い医薬品は、有機酸輸送系、中性アミノ酸輸送系などの腎尿細管分泌に関わる能動輸送系の寄与が大きい。これまでに、有機酸輸送系により腎尿細管から速やかに排泄される腎機能診断薬である99mTc-メルカプトアセチルトリグリシン (99mTc-MAG3)において、有機酸輸送系阻害剤の併用が尿中排泄遅延効果を有することを確認している [Shikano N.; 2004c32)]。そこで、アミノ酸輸送系により腫瘍に高く集積する125I-IAMTの腎尿細管分泌機序を詳細に検討し、組織集積には関与しない有機酸輸送系が、腎尿細管分泌においては特異的に寄与していることを明らかにした [Shikano N.; 2004a29)]。さらに、尿細管分泌輸送系を競合阻害により一過性に抑制して、医薬品の投与後早期の血中濃度低下を遅延させ、腫瘍などの標的組織への組織移行性を向上させる薬物動態制御法を開発した [川井恵一; 200533)]。事実、ヒト腫瘍細胞移植マウスにおいて有機酸輸送系阻害剤との併用により腎排泄が抑制され、125I-IAMTの腫瘍集積を向上し得ることを報告した (Fig.6) [Nakajima S.; 200734)]。このように、腎尿細管輸送を一過性に制御することによって画像診断薬の標的組織移行性を改善できることを示した。
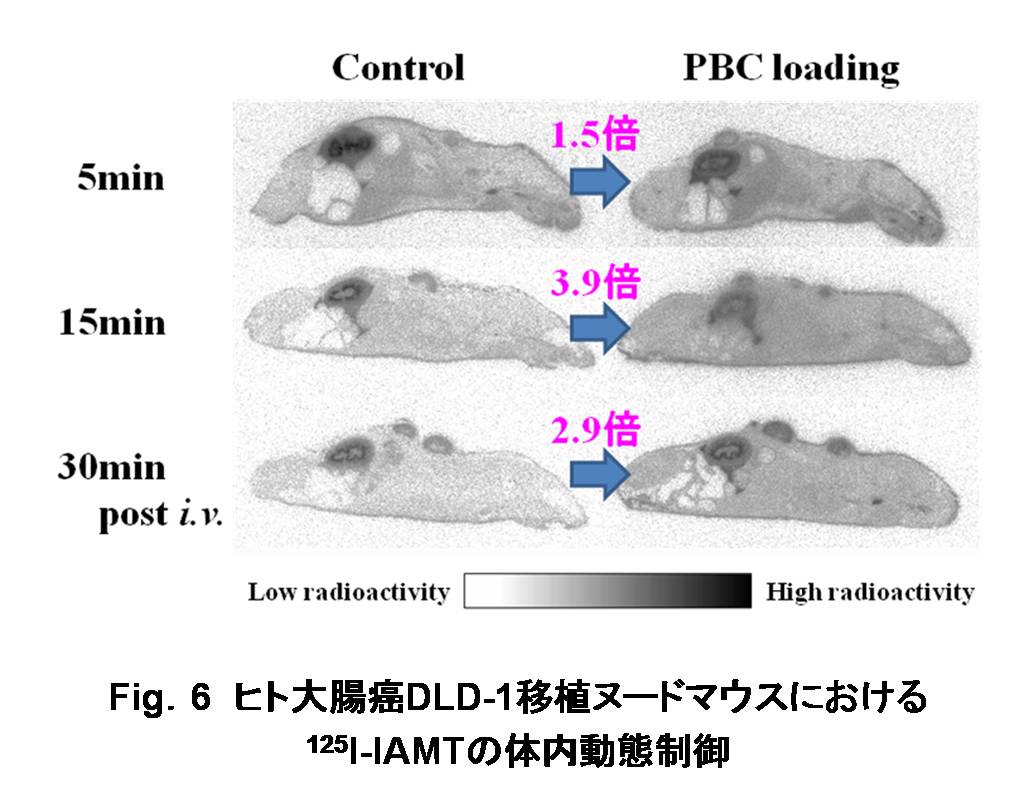 |
血清蛋白結合置換による放射性医薬品の体内動態制御
また、血中に移行した薬物の中には、血清蛋白との結合が強いために組織移行性が損なわれているものがあること、これらの薬物の結合蛋白および特異的結合部位に競合して結合性を示す薬物の併用によってその作用が増大することは、副作用の観点から良く知られている。そこで、薬物の組織移行性の向上と排泄促進による副作用軽減を目的として、この蛋白結合置換を安全性の高い薬物の併用による薬物動態制御法として積極的に活用することを計画し、放射性画像診断薬をモデル化合物として、血清蛋白結合置換による蛋白結合率の変化が医薬品の体内動態に与える影響をイメージングにより定量的に検証した。既に、血清蛋白結合性が高いため、標的組織への効率的移行が妨げられている放射性医薬品に対して、血清蛋白上の特異的結合部位において競合置換を示す蛋白結合親和性の高い薬剤または栄養素などを併用することによって、組織移行性の決定因子である放射性医薬品の血中遊離濃度を制御し、標的組織への集積性を向上させ得ることを示した [Kawai K.; US 702965335)]。また、数種の画像診断薬に関して、血清蛋白上の結合部位を同定すると共に当該部位で競合阻害効果を示す安全性の高い置換薬を併用し、その結果、医薬品の標的組織への集積性を顕著に向上させ、同時に体外排泄を促進させ得ることを実証した。健常人ボランティアやサルにおける薬物動態変化を検討した結果、排泄促進作用および組織集積性の顕著な向上が認められた [Kawai K.; 200336)]。この薬物動態制御法を治療薬へ応用したところ、慢性リウマチ患者の鎮痛効果が大幅に改善するなど、患者のQOL向上に役立つことが確認された [高村徳人; 200337), 200738)]。
放射性医薬品の中でも、脳血流診断薬である 123I-N-イソプロピル-p-ヨードアンフェタミン (123I-IMP) は、血清蛋白結合性が高いため脳への移行が妨げられている。そこで123I-IMPの脳集積率向上を目的として、ヒト血清における 123I-IMPの結合蛋白種を同定したところ、ヒト血清アルブミン (HSA) およびα1-酸性糖蛋白(AGP)に結合していることが確認された。また、HSA site IIおよびAGPの特異的結合部位において 123I-IMPと競合する安全性の高く臨床応用の可能な結合置換薬を検索し、それらの置換薬の添加による結合置換効果を検証したところ、123I-IMPの血中遊離率が顕著に上昇した [Kawai K.; 200939)]。
さらに、より人体に安全かつ効果的に投与できる置換薬として、栄養素であるアミノ酸輸液製剤に着目し、その血清蛋白結合置換薬としての有用性を評価した。結合サイトマーカを用いてアミノ酸輸液成分の特異的結合部位を検索したところ、アミノ酸輸液製剤はHSA site IIおよびAGPの結合置換薬として用い得ることが確認された。事実、ヒト血清にアミノ酸輸液製剤を負荷した場合、123I-IMPの血中遊離率が上昇し、顕著な置換率が得られたことから、123I-IMPの蛋白結合置換による経時的体内動態変化に関する検討を行った。サル脳シンチグラフィにおいて、血清蛋白結合置換薬としてアミノ酸輸液を負荷した場合、無負荷時と比較して 123I-IMPのサル脳への集積が顕著に向上したが、一方、脳内局在には変化を与えなかった (Fig.7) [Kuga N.; 200940)]。この動態制御法は即座にヒトへの応用が可能であり、放射性医薬品の投与量や被曝の低減、また検査時間の短縮や診断画像の画質改善が期待される。これらの結果をまとめた論文が掲載されたJ. Nucl. Med. 50巻8号に「The Importance of Kinetic Enhancement」と題する本研究に対するInvited Perspectiveが掲載され、医薬品開発研究の新たな方向性であると絶賛された [Berridge MS.; 200941)]。
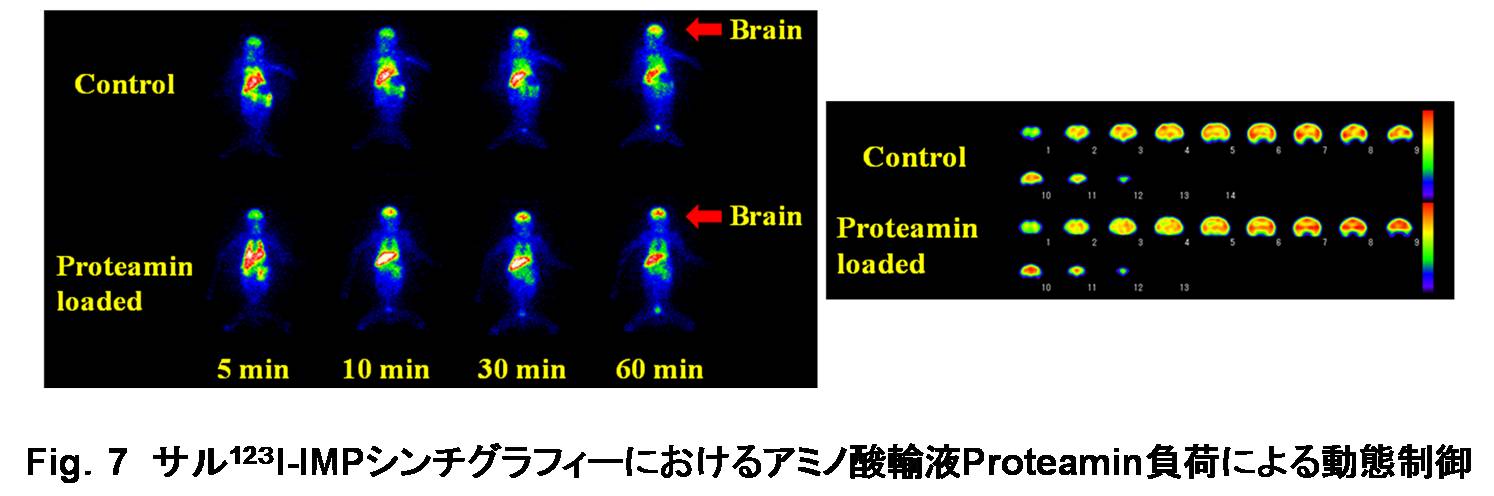 |
癌のRI内用療法と新製剤開発
一方、放射線治療は、外科的摘出手術、化学療法と相補う癌の治療法として活用されてきた。これまでの放射線治療は、主に体外より腫瘍部位に放射線を照射する体外照射法と針・粒などに密封した放射性核種を患部に埋め込む密封小線源法によって行われてきた。これらに加え、殺細胞効果を有する放射線を放出する核種で標識した放射性医薬品を体内に投与し、標的部位にターゲティングすることで治療を行うRI内用療法が注目を集めている。従来の体外照射法が予め病変部位の位置と大きさを確認した上で実施されるものであったのに対し、RI内用療法では癌の病巣部位を特定する必要がなく、多発性腫瘍・転移巣さらには所在不明・未確認病巣をも治癒できる点で極めて有効である。
本邦では、甲状腺癌、甲状腺機能亢進症の治療薬として、131I-ヨードカプセルが臨床使用されているが、この製剤の特筆すべき特徴は、診断薬として用いられている 123I-ヨードカプセルによって同一の患者における病巣あるいはそれ以外の投与量規定組織への体内動態を予めモニタリングできる点にある。すなわち、治療の対象となる個人の投与量当りの集積量が治療前に定量化されるため、個別に最適な投与量の算出が可能である。同様に、神経芽細胞腫などのカテコラミン産生細胞腫の治療に 131I-m-ヨードベンジルグアニジン (131I-MIBG) が使われるが、そのモニタリングに 123I-MIBGが用いられる。ただ、131I-MIBGのRI内用療法は保険適用外であり、その実施には放射線障害防止法が適用される特別な治療病床が必要となるため、金沢大学など限られた大学病院でのみ行われている。
一方、薬剤の標的部位集積性の観点から免疫学的特異性を利用し、癌特異抗原を選択的に認識するモノクローナル抗体を殺細胞性の高い治療用放射性核種で標識して効果的治療を目指す放射免疫療法 (radioimmunotherapy, RIT) の実用化が待ち望まれていた。本邦でも2008年より 90Y標識抗CD20モノクローナル抗体製剤であるゼバリンの使用が開始され、これらのRI内用療法開始後1月以内の完全寛解例など優れた著効性が報告されている。この内用療法では、90Y標識体による治療に先立ち、同じ抗体の111In標識体を投与して患者個別にその分布を確認するため、副作用発現を回避することができる。
このように、治療薬と同じ体内動態を示す診断用放射性医薬品を用いたイメージングによって、治療前モニタリングを実施し、その結果に基づいて当該薬物療法の施行や投与量の決定を行うことを次に述べる「ターゲティングコンファーマティブ個別化医療」として提唱している。このための放射性核種の組み合わせには、ヨードカプセルやI-MIBGのように123Iで診断、131Iで治療と放射性ヨウ素の同位元素を使い分けるほか、共通のキレート剤と錯体を形成できる金属核種として、先に述べた111In-90Yおよび診断用99mTcに対する治療用186Reまたは188Reなどの臨床応用が期待されている。
加えて、次世代のRI内用療法を目指した新しい放射性医薬品の開発も数多く提唱されている。詳細は省略するが、特に分子標的薬剤の設計戦略を応用した我々の試みにおいても、例えば、投与前モニタリングが可能なRI内用療法を目指した放射性ヨウ素標識化合物として、血管新生因子であるVEGFなどの生理活性ペプチドの標識に利用した (Fig.8) [Yoshimoto M.; 200642)]。
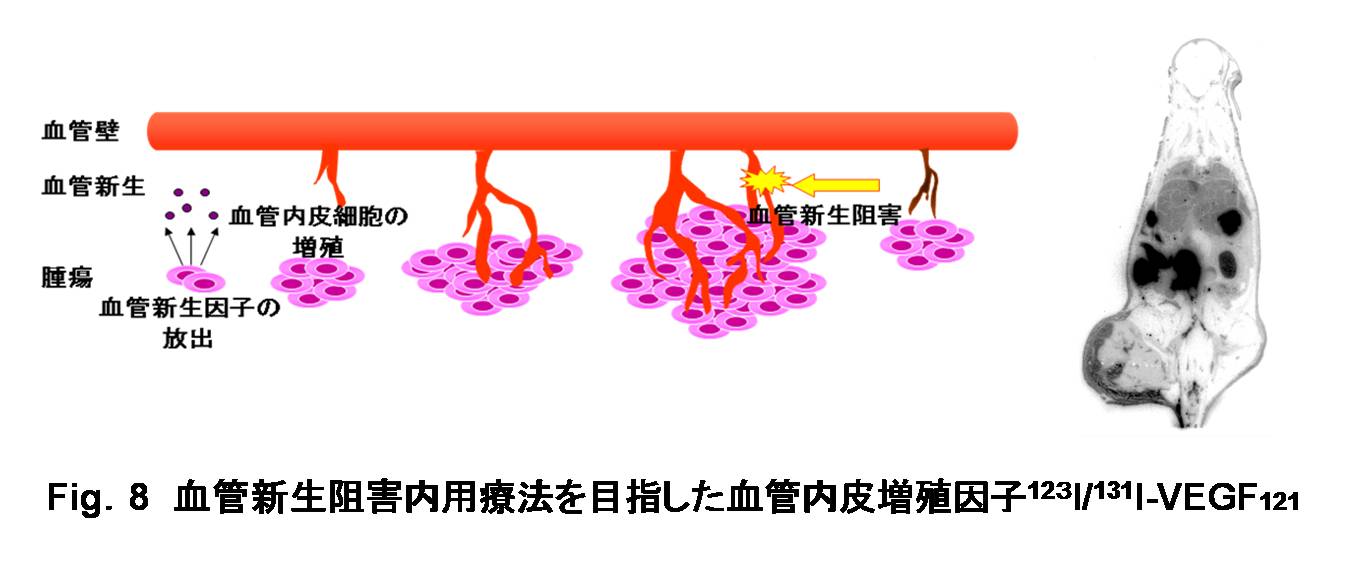 |
さらに、血管新生や癌の浸潤、転移における細胞接着において重要な役割を果たすことが知られているαvβ3インテグリンは、アルギニン-グリシン-アスパラギン酸 (Arg-Gly-Asp: RGD) 配列を認識して特異的に結合することから、αvβ3との結合性を保持しながら代謝安定性を示す環状アルギニン-グリシン-アスパラギン酸-D-フェニルアラニン-リジン (c(RGDfK)) 構造に、111In-90Yの利用を推進する目的で両標識核種と安定に錯体形成するキレート剤DOTAを導入したDOTA-c(RGDfK)による腫瘍イメージングと内用照射治療の可能性について検討した (Fig.9) [Yoshimoto M.; 200843)]。
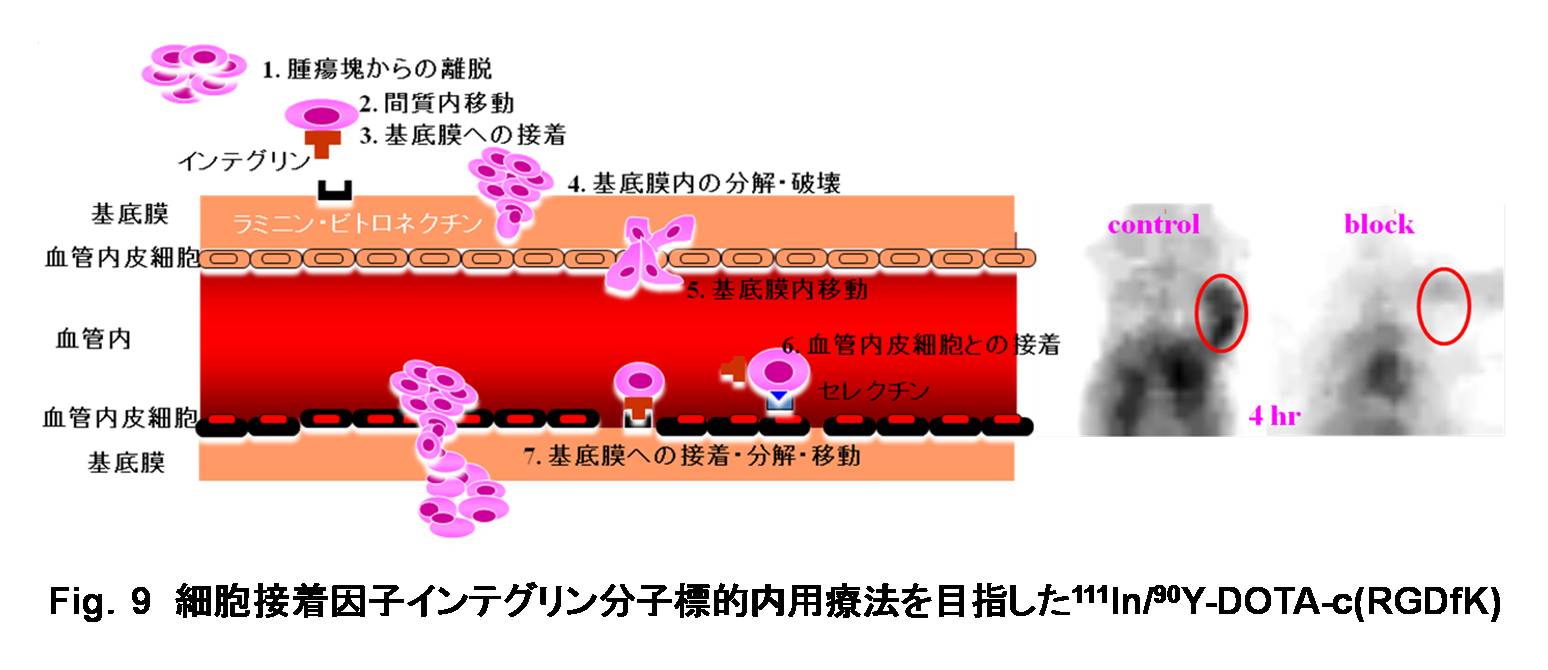 |
ターゲティングコンファーマティブ個別化医療
近年、病態に関連する機能性分子に直接作用し、著効性を示す分子標的薬剤などの有効性の高い医薬品が薬物療法に適用され始めているが、薬効や副作用に個体差が大きく、十分な治療効果が得られないばかりか、副作用のみが現れる場合もある。加えて、現状の個別化医療はもっぱら標的分子や遺伝子変異の有無といった標的組織を対象とした質的診断に基づいており、有効性の限界、副作用の問題が必ずしも回避できない状況にある。このように患者間で薬物療法の有効性に相違が見られる原因として、医薬分子のターゲティング性の欠如が考えられることから、真の個別化医療を実現するためには薬剤の体内動態を定量的に個別に評価し、標的組織のみならず副作用発現部位への薬剤集積量を確認することが不可欠である。昨今、測定原理の異なる様々なイメージング法が提唱されているが、標的分子特異的放射性プローブを用いた核医学画像診断法は、まさにこの情報を定量的に把握し得る手法であり、本稿で紹介したトランスポータや受容体などの生体内の機能性分子に応答して薬剤の体内物流を指標に生体機能を経時的に可視化する「体内物流イメージング」は、薬剤の定量的体内動態情報の把握に大きく貢献するものと期待される。特に小動物専用の高分解能PET・SPECT装置も開発され、マウスなどの小動物からヒトに至るまで、同じ放射性プローブによる同一のプロトコールが適用可能であることが最大の特徴であり、まさにトランスレーショナルに相応しい分子イメージング法である。
核医学画像診断は、画像診断薬剤の体内動態に基づき病気を診断する診療技術であるが、同時に放射性薬剤の組織集積性を評価できる可視化定量法でもある。分子標的薬剤や遺伝子診断情報に基づく現行の個別化医療における課題である効果不足や副作用の発現に大きく影響する体内物流は個体差が大きく、さらに同一個体内でも変動するため、治療時における患者個別の評価が必要である。患者個々の薬効成分の標的組織への集積率を確認することで、その患者における薬剤の有効性を評価して使用薬剤を決定し、さらには副作用部位における集積率から薬剤の安全性を評価して副作用を回避できる投与量を決めるとともに、必要に応じてこれらの情報から使用薬剤を再検討することが可能となる。このようにイメージングによる薬剤の組織集積性に基づく治療方針の決定によって、薬物療法における副作用をなくし、薬効のみが期待できる次世代型個別化医療、すなわち「ターゲティングコンファーマティブ治療 (Targeting Confirmative Therapy: TCT)」の実践を可能にすると考えている。
参考文献――――――――――――――――――――
1) Kawai K., Fujibayashi Y., Saji H., et al. A strategy for the study of cerebral amino acid transport using 123I-labeled amino acid radiopharmaceutical: 3-Iodo-alpha-methyl-L-tyrosine. J. Nucl. Med., 1991; 32(5): 819-824.
2) Kawai K., Fujibayashi Y., Yonekura Y, et al. An artificial amino acid radiopharmaceutical for single photon emission computed tomographic study of pancreatic amino acid transports: 123I-3-Iodo-alpha-methyl- L-tyrosine. Ann. Nucl. Med., 1992; 6(3): 169-175.
3) Kawai K., Fujibayashi Y., Yonekura Y, et al. Canine SPECT studies for cerebral amino acid transport by means of 123I-3-iodo-α-methyl-L-tyrosine and preliminary kinetic analysis. Ann. Nucl. Med., 1995; 9(1): 47-50.
4) Kawai K., Flores II L.G., Nishii R., et al. Effect of esterification on cerebral accumulation of radiopharmaceuticals with carboxylic acid. J. Labelled Compd. Radiopharm., 1999; 42(S1): S423-425.
5) Kawai K., Kodama H., Jinnouchi S., et al. 3-[123I]Iodo-α-(difluoromethyl)tyrosine methyl ester, a new radiopharmaceutical for amino acid decarboxylase measurement. J. Labelled Compd. Radiopharm., 1997; 40(S1): S701-703.
6) Ishida Y., Kawai K., Magata Y., et al. Changes in dopamine D2 receptors and 6-[18F]fluoro-L-3,4-dihydroxyphenylalanine uptake in the brain in 6-hydroxydopamine lesioned rats. Neurodegenerative Dis., 2004; 1(2-3): 109-112.
7) Ishida Y., Kawai K., Magata Y., et al. Alteration of striatal [11C]raclopride and 6-[18F]fluoro-L-3,4-dihydroxyphenylalanine uptake precedes development of methamphetamine-induced rotation following unilateral 6-hydroxydopamine lesions of medial forebrain bundle in rats. Neurosci. Lett., 2005; 389(1): 30-34.
8) Kobayashi M., Shikano N., Kawai K, et al. Comparison of the transcellular transport of FDG and D-glucose by the kidney epithelial cell line LLC-PK1. Nucl. Med. Commun., 2010; 31(2): 141-146.
9) 川井恵一,吉本光喜.Post-FDGを目指した新規腫瘍診断用PET製剤の開発動向.日本放射線技術学会雑誌, 2006; 62(6): 764-770.
10) Blau M., Manske RF. The pancreas specificity of Se75-selenomethionine. J. Nucl. Med., 1961; 2(1): 102-105.
11) Blomquist L., Flodh H., Ullberg S. Uptake of 125I-labelled 4-iodophenylalanine in tumours of mice. Br. J. Cancer, 1968; 23(1): 150-153.
12) Counsell RE., Smith TD., Diguilio W., et al. Tumor localizing agents VIII: Radioiodinated phenylalanine analogs. J. Pharm. Sci., 1968; 57(11): 1958-1961.
13) Fujibayashi Y., Kawai K., Yonekura Y., et al. Problems of [S-methyl-11C]-L-methionine as a protein synthesis marker in the pancreas. Ann. Nucl. Med., 1990; 4(1): 29-33.
14) Akedo H., Christensen HN. Transfer of amino acids across the intestine: A new model amino acid. J. Biol. Chem., 1962; 237(1): 113-117.
15) Dunzendorfer U., Schmall B., Bigler RE., et al. Synthesis and body distribution of alpha-aminoisobutyric acid-L-11C in normal and prostate cancer-bearing rat after chemotherapy. Eur. J. Nucl. Med., 1981; 6(11): 535-538.
16) Hayes RL., Washburn LC., Wieland BW., et al. Carboxyl-labeled 11C-1-aminocyclopentanecarboxylic acid, a potential agent for cancer detection. J. Nucl. Med., 1976; 17(8): 748-751.
17) Washburn LC., Sun TT., Byrd B., et al. 1-Aminocyclobutane[11C]carboxylic acid, a potential tumor-seeking agent. J. Nucl. Med., 1979; 20(10): 1055-1061.
18) Inoue T., Tomiyoshi K., Higuichi T., et al. Biodistribution studies on L-3-[fluorine-18]fluoro-α-methyl tyrosine: A potential tumor-detecting agent. J. Nucl. Med., 1998; 39(4): 663-667.
19) Shoup TM., Olson J., Hoffman JM., et al. Synthesis and evaluation of [18F]1-amino-3-fluoro- cyclobutane-1-carboxylic acid to image brain tumors. J. Nucl. Med., 1999; 40(2): 331-338.
20) 金井好克.アミノ酸輸送体の多様性.Mol. Med., 2003; 40(7): 782-790.
21) Shikano N., Kanai Y., Kawai K., et al. Isoform selectivity of 3-125I-iodo-α-methyl-L-tyrosine membrane transport in human L-type amino acid transporters. J. Nucl. Med., 2003; 44(2): 244-246.
22) Langen KJ., Mühlensiepen H., Holschbach M., et al. Transport mechanisms of 3-[123I]iodo-alpha-methyl- L-tyrosine in a human glioma cell line: Comparison with [3H-methyl]-L-methionine. J. Nucl. Med., 2000; 41(7): 1250-1255.
23) Shikano N., Kotani T., Nakajima S., et al. Radioiodinated 4-iodo-L-meta-tyrosine, a system L selective artificial amino acid: Molecular design and transport characterizationin in Chinese hamster ovary cells (CHO-K1 cells). Nucl. Med. Biol., 2010; 37(8): 903-910.
24) Okudaira H., Shikano N., Nishii R., et al. Putative transport mechanism and intracellular fate of anti-18F-FACBC (trans-1-amino-3-18F-fluorocyclobutanecarboxylic acid) in human prostate cancer. J. Nucl. Med., 2011; 52(5): 822-829.
25) Nishii R., Kagawa S., Kawai K, et al. Comparison of system A and system L amino acid transports in human pancreas with C-11 MeAIB and C-11 MET PET study. J. Nucl. Med., 2009; 50(Suppl.2): 1727.
26) Higashi T., Nishii R., Kawai K, et al. Usefulness of new amino acid radiotracer, [11C]MeAIB, in the oncologic PET diagnosis of chest malignancies. J. Nucl. Med., 2010; 51(Suppl.2): 1257.
27) Haruta S., Kawai K., Jinnouchi S., et al. Evaluation of absorption kinetics of orally administered theophylline in rats based on gastrointestinal transit by gamma scintigraphy. J. Pharm. Sci., 2001; 90(4): 464-473.
28) Haruta S., Kawai K., Nishii R., et al. Prediction of plasma concentration-time curve of orally administered theophylline based on a scintigraphic monitoring of gastrointestinal transit in human volunteers. Int. J. Pharm., 2002; 233(1-2): 179-190.
29) Shikano N., Kawai K., Nakajima S., et al. Renal accumulation and excretion of radioiodinated 3-iodo-α-methyl-L-tyrosine. Ann. Nucl. Med., 2004; 18(3): 263-270.
30) Shikano N., Kanai Y., Kawai K., et al. Characterization of 3-[125I]iodo-α-methyl-L-tyrosine transport via human L-type amino acid transporter 1. Nucl. Med. Biol., 2003; 30(1): 31-37.
31) Shikano N., Kawai K., Nakajima S., et al. Transcellular transport of radioiodinated 3-iodo-α-methyl-L-tyrosine across monolayers of kidney epithelial cell line LLC-PK1. Ann. Nucl. Med., 2004; 18(3): 227-234.
32) Shikano N., Kanai Y., Kawai K., et al. Transport of 99mTc-MAG3 via rat renal organic anion transporter 1. J. Nucl. Med., 2004; 45(1): 80-85.
33) 川井恵一,高村徳人,鹿野直人,西井龍一.腎臓トランスポーターによる薬物動態の制御方法および製剤.日本国特許, 2005; 特開2005-112750.
34) Nakajima S., Shikano N., Kawai K, et al. Pharmacokinetics of 3-[125I]iodo-α-methyl-L-tyrosine, a tumor imaging agent, after probenecid loading in mice implanted with colon cancer DLD-1 cells. Nucl. Med. Biol., 2007; 34(8): 1003-1008.
35) Kawai K., Nishii R., Takamura N. Method of the administration of drugs having binding affinity with plasma protein and preparation to be used in the method. US Pat., US 7029653: Euro Pat., EP 1197227.
36) Kawai K., Takamura N., Nishii R., et al. Competitive displacement of serum protein binding to regulate pharmacokinetics. Proceedings of International Symposium on Serum Albumin and α1-Acid Glycoprotein from Basic Sciences to Clinical Applications: Eds. Otagiri M., Sugiyama Y., Testa B. and Tillement JP., 2003; pp181-192.
37) 高村徳人,奥村 学,川井恵一,他.関節リウマチ(RA)患者に対する鎮痛薬ナブメトンの効果的な投与法.医薬ジャーナル, 2003; 39(3): 1041-1046.
38) 高村徳人,徳永 仁,川井恵一,他.薬剤師に必要なタンパク結合置換術.薬学雑誌, 2007; 127(11): 1805-1811.
39) Kawai K., Nishii R., Shikano N., et al. Serum protein binding displacement: Theoretical analysis using a hypothetical radiopharmaceutical and experimental analysis with 123I-N-isopropyl-p-iodoamphetamine. Nucl. Med. Biol., 2009; 36(1): 99-106.
40) Kuga N., Shikano N., Kawai K., et al. Competitive displacement of serum protein binding of radiopharmaceuticals with amino acid infusion investigated with N-isopropyl-p-123I-iodoamphetamine. J. Nucl. Med., 2009; 50(8): 1378-1383.
41) Berridge MS. The importance of kinetic enhancement. J. Nucl. Med., 2009; 50(8): 1203-1204.
42) Yoshimoto M., Kinuya S., Kawai K., et al. Radioiodinated VEGF to image tumor angiogenesis in a LS180 tumor xenograft model. Nucl. Med. Biol., 2006; 33(8): 963-969.
43) Yoshimoto M., Ogawa K., Kawai K., et al. αvβ3 Integrin-targeting radionuclide therapy and imaging with monomeric RGD peptide. Int. J. Cancer, 2008; 123(3): 709-715.